Ein asymmetrischer Ring aus fadenförmigen Proteinen zerteilt die Zelle in zwei Tochterzellen
Symmetrie ist ein Grundmerkmal der meisten mehrzelligen Tiere. Doch bei der Zellteilung von embryonischen Zellen herrscht Asymmetrie. Ein Team um Prof. Dr. Esther Zanin vom Department Biologie der Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU) hat ein Arbeitsmodell entwickelt, das den molekularen Mechanismus erklärt, mit dem das Protein Anillin die Asymmetrie bei der Einschnürung der Mutterzelle steuert. Da Anillin in Tumorzellen in großen Mengen vorkommt, könnte der vermutete Mechanismus ein Türöffner für neue Krebsmedikamente sein.
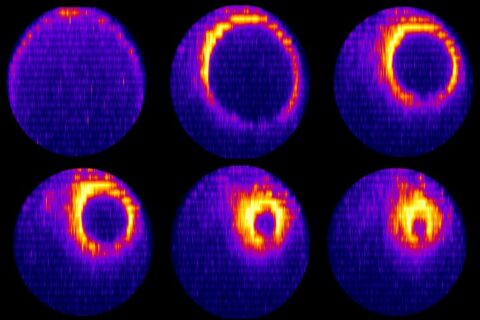
Die Teilung einer Zelle lässt sich live unter dem Lichtmikroskop beobachten. Zu Beginn bildet sich am Äquator der Mutterzelle ein Ring aus fadenförmigen Aktin-Proteinen, der sich symmetrisch zusammenzieht. Im weiteren Verlauf wird der Ring asymmetrisch, das heißt er kontrahiert an einer Stelle stärker als am gegenüberliegenden Ende. Der Durchmesser des Rings verkleinert sich immer weiter bis die Trennung der Mutterzelle vollzogen ist. Was diese Ringasymmetrie auslöst, war bisher unklar. Bekannt war nur, dass der Prozess von der mechanischen Fließbewegung der Aktinfasern und dem Protein Anillin gesteuert wird. Ohne den Einfluss von Anillin kontrahiert der Ring symmetrisch.

(Bild: privat)
Embryonen eines Fadenwurms
Im Labor von Prof. Zanin von der Professur für Experimentelle Molekulare Zelldynamik der FAU wird die erste Zellteilung von Embryonen des Fadenwurms Caenorhabditis elegans untersucht. Die 50 tausendstel Millimeter (μm) langen und 20 μm breiten Zellen lassen sich zwar gut fotografieren, doch die Bilder des Lichtmikroskops reichen nicht aus, um den Prozess auf molekularer Ebene zu beobachten. Es können jedoch Bestandteile des kontraktilen Rings mit Fluoreszenzproteinen markiert und so mit einem Fluoreszenzmikroskop sichtbar gemacht werden. Mikhail Lebedev, Erstautor der Studie, hat dabei im Fadenwurmembryo gentechnisch verschiedene Mutationen des aus 1159 Aminosäuren bestehenden Anillin erzeugt, bei denen die Andockregionen des Proteins verändert wurden. Mit jeder Proteinvariante wurde der Ablauf der Zellteilung und das Zusammenschnüren des Rings alle 15 Sekunden fotografisch dokumentiert. Dabei stellte sich heraus, dass es zwei Regionen (Domänen) auf dem großen Molekül gibt, die Einfluss auf die Ringasymmetrie haben: Eine kugelförmig gefaltete (globuläre) Domäne und eine sehr flexible Region aus ungefalteten Aminosäure-Strängen.
Der Ring schnürt sich zusammen, wenn seine Aktinfasern unter Mitwirkung des „Motorproteins“ Myosin ineinander gleiten. Myosin wiederrum muss von einer aktiven Variante des Schalterproteins RhoA angeschaltet werden, damit es seine Motorfunktion erfüllen kann. Das Schalterprotein wiederum besitzt eine Region, die zwischen zwei verschiedene Zuständen hin und her schalten kann – wobei die aktive Form Myosin aktiviert und die inaktive Form nicht zu einer Myosin-Aktivierung führt.
Der Schalter wird von Anillin blockiert
Das Team von Prof. Zanin konnte nun zeigen, dass Anillin nicht die Schalterfunktion von RhoA beeinflusst, sondern einfach die aktive Form des Schalters unzugänglich macht. Wenn die gobuläre Domäne von Anillin an das aktive Schalterprotein RhoA andockt, wird das Binden von anderen Proteinen verhindert und der Motor Myosin bleibt inaktiv. Diese Bindung wird von der flexiblen Region des Anillin sogar noch verstärkt. Beides führt zu einer Verlangsamung der Kontraktion an einer Seite des Rings und somit zur Asymmetrie.
Die globuläre und flexible Region des Anillin-Moleküls beeinflussen die Ringasymmetrie offenbar gemeinsam. Das Team von Prof. Zanin vermutet, dass die flexible Region des Anillin in irgendeiner Form die mechanischen Strömungen der Aktinfasern „wahrnimmt“ und die Bindungsfähigkeit der globulären Domäne anpasst. Starke Strömungen bewirken eine schwache Bindung der kugelförmigen Domäne des Anillin an RhoA, so dass der Schalter auf „on“ steht, das Motorprotein Myosin aktiviert wird und sich der Ring in diesem Bereich stärker zusammenzieht als am gegenüberliegenden Ende. Dies führt unweigerlich zu einer Asymmetrie.
Dagegen bewirken schwache Strömungen eine starke Bindung an RhoA, wodurch die Kontraktion abgeschwächt wird. Offenbar hat die Fließgeschwindigkeit der Aktinfasern einen großen Einfluss auf die Asymmetrie des abschnürenden Rings. Wie die flexible Region des Anillin-Proteins diese Strömung „wahrnimmt“ und diese Information an die kugelförmige Domäne weiterleitet, wird Gegenstand weiterer Grundlagenforschung sein. Die Verwandtschaft aller Tiere macht es möglich: Ein asymmetrisches Einschnüren des Rings wurde nicht nur beim Fadenwurm sondern auch in menschlichen Hautzellen beobachtet. Somit könnte diese Arbeit beispielsweise auch für das Verständnis der Schutzfunktion menschlicher Haut oder die Eindämmung von Tumorzellen von Bedeutung sein.
*DOI: 10.1083/jcb.202405182
Weitere Informationen:
Prof. Dr. Esther Zanin
Professur für Experimentelle Molekulare Zelldynamik
https://www.zelldynamik.nat.fau.de
esther.zanin@fau.de